北方伟业计量集团有限公司
-
登录 |
-
官方微信 |

-
在线支付 |
- 网站地图
- 产品
- 帖子
- 新闻
- 课堂
- 文库
北方伟业计量集团有限公司








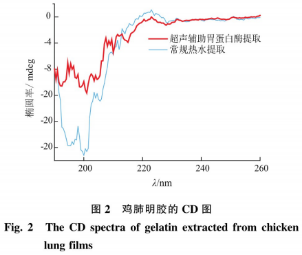
通常,胶原在CD光谱图中会表现出典型的三股螺旋结构的分子特征,即在220~230nm和200nm处分别出现正吸收峰和负吸收峰。由图2可见,超声辅助酶提明胶在201nm波长处存在负吸收峰,在223nm波长出现了一定程度的正吸收峰。220~230nm波段的正值吸收对应蛋白质α-螺旋,胃蛋白酶切断胶原分子的N及C端的非胶原性肽,对胶原的三螺旋结构无明显影响,但会导致仪链的降解,导致正吸收峰不明显。有研究表明,负峰强度越大,无规则卷曲程度越大,图2中胃蛋白酶提取的明胶的负峰强度明显小于常规热水提取的明胶,胶原的三螺旋结构较为完好,与郑雅爻等的测试结果相符。利用胃蛋白酶提取的明胶形成类胶原三股螺旋结构,天然胶原的仪一螺旋部分解链,但仍维持着胶原的三螺旋结构,说明超声辅助酶提明胶的二级结构更加有序。
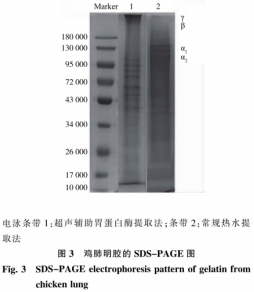
采用SDS-PAGE检测明胶样品的亚基组成与相对分子质量分布,明胶分子包含α1、α2、β这3条链,相对分子质量在130000~250000之间。鸡肺胶原转变为明胶的过程涉及次级键的断裂,随机断裂的键造成了胶原水解产物组分的多样化,明胶分子既可能是单链,也可能是α链片段的共价交联体。如图3,电泳条带2显示,常规热水提取的鸡肺明胶组分包括αl、α2链,以及不清晰的小分子片段,与李越在SDS-PAGE图谱中观察到的市售明胶类似。鸡肺胃蛋白酶提取的明胶电泳条带1没有明显的α1、α2、β这3条链对应的电泳条带中出现45000~95000之间的一些占绝大部分的蛋白降解条带,没有明显的α1、α2、β这3条链对应的电泳条带。在酸性条件下用胃蛋白酶处理可切断胶原分子N及C端的非胶原性肽,导致α、α2链的展开。超声波可以对鸡肺胶原的三螺旋结构造成轻微降解,氢键的断裂使得肽链变得松散,利于后期酸性pH条件下的酶处理。随着酶解时问的延长,加热过程中胶原的肽端受到破坏,分子问的共价键断裂,高分子组分更容易降解,明胶分子游离出来。孙艺等在提取大目金枪鱼皮明胶中的发现,内源性蛋白酶的存在使明胶降解为小分子,电泳条带1中出现了低于45000的几条模糊的小分子蛋白条带,可能是由于进一步的酶解,明胶断裂为更小的分子。也可能是在酸性条件下浸提使明胶发生了热降解,溶胀的胶原由于其疏松的结构在热水提取时更容易降解。
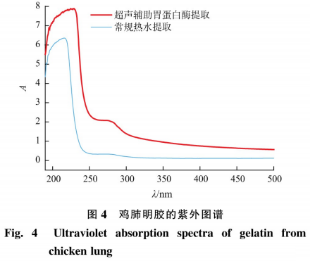
明胶中由于存在C=0、CONH2、-C00H等发色基团,紫外特征吸收峰通常出现在220nm波长左右,结果见图4。与图中曲线吸收峰(229nm)吻合,证明明胶肽链分子中存在酰胺键,鸡肺明胶溶液的紫外吸收光谱与Chandra等的结果类似。大多数蛋白质中存在的一些芳香族氨基酸残基在波长270~280nm处存在紫外吸收峰,在一般经纯化的明胶中不会出现,超声辅助酶提明胶与常规热水提取的明胶在280nm处有微量吸收,说明明胶样品中只含有少量芳香族氨基酸,可以初步判断试验提取的鸡肺明胶具有较高的纯度。超声辅助酶提明胶的杂峰较常规热水提取的明胶杂峰更明显。
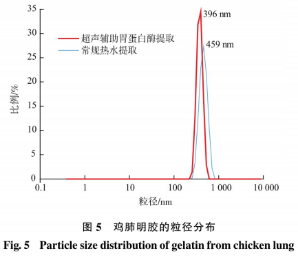
由图5可知,超声辅助胃蛋白酶提取的明胶平均粒径为396nm,小于常规热水提取。超声波处理会改变明胶的二级结构,Yu等的研究表明超声波处理过的明胶,其平均粒径显著下降。可能是由于超声波的物理效应对分子问静电作用的破坏以及气穴效应产生的强剪切力,使得后续酶解过程中胶原的三螺旋结构解链程度较高,分子间的交联键断裂更为彻底,大分子蛋白进一步降解得到明胶亚基,与SDS-PAGE分析所得结果一致。
鸡肺明胶的微观结构利用SEM观察,与常规热水提取的鸡肺明胶(图6(b))相比,经过超声辅助酶提取的明胶化胶原(图6(a)),表面有较大程度的破碎,甚至出现较多的孔洞,这一变化与陈书霖等研究的不同酸预处理下鲢鱼皮明胶的表观类似。在酸性条件下胶原分子问的排斥力会增强,结果导致胶原在乙酸浸泡过程中逐渐发生溶胀.胶原表观被明显破坏。超声波对明胶的分子结构起到疏松的效果,鸡肺胶原蛋白问原本紧密的交联变得松散,有利于后期在酸性条件下进行的酶解,使分子间的共价交联和非共价键断裂,大分子的胶原蛋白绝大多数被降解为小分子的胶原亚基,可能导致分子间疏水基团的暴露,明胶化胶原呈无规则卷曲状。超声辅助酶提明胶具有疏松孔洞的结构特点,在糖果工业中,可作为搅打剂应用于软糖的生产,起吸水、增大体积、维持形态的作用。

明胶作为一种亲水、亲油的表面活性剂,肽链的疏水基因使其具有一定的乳化性,可以阻止晶体或离子的聚集,稳定非均相悬浮液。高速匀浆机的分散作用使得明胶分子与油滴界面接触的数量增多,溶液中的明胶蛋白覆在油滴表面形成水包油的状态。制备的两种明胶的乳化活性无明显差异,其中超声辅助酶提明胶的乳化稳定性((139.92±9.8)min)略低于常规热水提取明胶((148.72±11.3)min),但仍显著高于鲶鱼皮明胶网(<60min)。乳液中分子间的吸引力与运动碰撞形成了较大的液滴,其表面的解吸附作用使得液滴变得不稳定,均质后的明胶会出现一些较大的乳液液滴。明胶分子与油滴界面问的疏水平衡随着明胶溶解度的降低而被破坏,超声辅助酶提明胶的乳化稳定性南于乳液粒径的增大而出现下降,可通过添加表面活性剂或修饰侧链基团对酶提明胶进行改性。
以鸡肺为原料提取明胶,通过分析其结构和乳化性,探究超声辅助酶法的影响。研究发现,在超声波和胃蛋白酶的作用下,鸡肺明胶的相对分子质量降低,表面微观结构疏松破碎,平均粒径减小13.7%。试验结果表明,鸡肺明胶具有较高的纯度,与常规热水法相比,超声辅助酶提明胶的生产周期显著缩短,得率显著提高,具有良好的热稳定性与乳化稳定性,二级结构更为有序,可作为鱼源明胶的替代品。
声明:本文所用图片、文字来源《食品与生物科技》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系

试验采用生产技术较简单的滴丸剂制备技术,将桑椹红色素与明胶甘油混合,利用搅拌机将滴入冷却液中的大丸打碎制成微丸,通过单因素试验筛选、L9(34)正交试验考查原料与基质配比、滴制温度、搅拌桨转速3个因素对微丸成型率和丸重变异系数的影响,优化桑椹红色素微丸的制备工艺。
了解更多> >采用酸碱法,通过单因素及正交试验确定了卵形鲳鯵加工副产物中明胶的提取工艺,并对最佳工艺条件下提取的明胶产品进行凝胶强度、黏度、光谱特性、分子量分布及氨基酸组成等理化性质测定。结果表明:卵形鲳鯵加工副产物中提取明胶的最佳工艺条件为NaOH浓度0.8%、Na0H时间处理2h、Hcl浓度0.4%、HCl处理时间1h,在最佳工艺条件下明胶得率为45.41%。
了解更多> >采用酸碱法,通过单因素及正交试验确定了卵形鲳鯵加工副产物中明胶的提取工艺,并对最佳工艺条件下提取的明胶产品进行凝胶强度、黏度、光谱特性、分子量分布及氨基酸组成等理化性质测定。结果表明:卵形鲳鯵加工副产物中提取明胶的最佳工艺条件为NaOH浓度0.8%、Na0H时间处理2h、Hcl浓度0.4%、HCl处理时间1h,在最佳工艺条件下明胶得率为45.41%。
了解更多> >采用酸碱法,通过单因素及正交试验确定了卵形鲳鯵加工副产物中明胶的提取工艺,并对最佳工艺条件下提取的明胶产品进行凝胶强度、黏度、光谱特性、分子量分布及氨基酸组成等理化性质测定。结果表明:卵形鲳鯵加工副产物中提取明胶的最佳工艺条件为NaOH浓度0.8%、Na0H时间处理2h、Hcl浓度0.4%、HCl处理时间1h,在最佳工艺条件下明胶得率为45.41%。
了解更多> >灵武长枣营养丰富,但近年来在产品加工转化方面深入研究不够,深加工产品单一,营养损失严重。针对以上问题,本文以灵武长枣为原料,开发出一款新型枣清汁饮品,达到理想的色泽、香气和协调的口感。研究确定了灵武长枣饮料的最佳配方,即焦枣汁17.99%,枣清汁55.00%,蔗糖2.95%,糖酸比为53:1。
了解更多> >通话对您免费,请放心接听
温馨提示:
1.手机直接输入,座机前请加区号 如13803766220,010-58103678
2.我们将根据您提供的电话号码,立即回电,请注意接听
3.因为您是被叫方,通话对您免费,请放心接听

登录后才可以评论